尿促一般打几针卵泡能成熟?尿促性素促排卵的疗程规律
尿促性素作为促排卵治疗的核心药物,其使用周期存在显著个体差异。临床数据显示多数患者需要持续注射7-12天,但具体疗程受基础卵泡数量、激素敏感度及治疗目标共同影响。生殖医生通常结合动态监测调整用药方案,而非固定注射次数。
卵泡发育的生理进程
正常月经周期中优势卵泡每日增长1-2毫米,尿促性素通过外源性促卵泡生成素(FSH)加速这个过程。初始卵泡直径达到10毫米后才具备药物响应性,此前注射属于启动准备期。药物敏感者可能在第5天即出现直径16毫米的成熟卵泡,而卵巢低反应人群可能需要15天以上刺激。
卵泡发育并非线性过程,约30%患者在治疗中会出现生长停滞现象。此时需评估雌激素水平波动,判断是否继续用药。双相性生长曲线并不罕见,部分卵泡可能在暂停注射后2-3天重新启动发育,这种现象与促黄体生成素(LH)受体激活程度相关。
剂量方案的动态博弈
启动剂量通常设定为75-150IU/日,相当于1-2支尿促性素注射剂。这个范围基于体重指数和抗缪勒管激素(AMH)值测算,肥胖患者可能需要上调20%-30%剂量。临床观察显示,剂量调整黄金期在治疗第5-7天,此时卵泡群对FSH的敏感性完全显现。
累积效应是疗程设计的关键考量。连续注射3天后,血清FSH浓度达到稳态水平,后续剂量主要维持而非增强刺激。过度反应风险在治疗第8天后显著升高,此时每增加1支药物,卵巢过度刺激综合征(OHSS)发生率提升8%-12%。
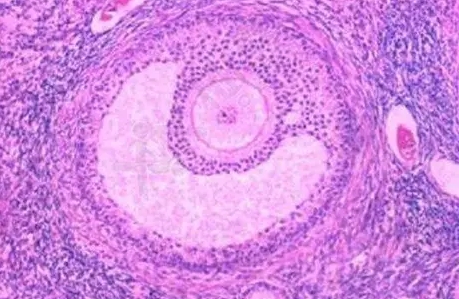
监测体系的双重校验
经阴道超声监测是疗程调整的基石。成熟卵泡的判定标准包括直径≥18毫米、透声良好且卵泡壁张力适中。三维超声可辅助观察卵丘细胞团,这个云雾状结构出现预示36小时内可能排卵。单周期监测频率通常为4-6次,集中在治疗中后期。
激素联检提供生化层面验证。雌激素水平每成熟卵泡应贡献200-300pg/ml浓度,当血清雌激素超过4000pg/ml时需警惕过度刺激。黄体生成素峰值的监测能预判自发排卵风险,尿促性素含有少量LH成分可能加速这个过程。
特殊情况的应对策略
多囊卵巢综合征患者需要更精细的剂量控制,初始剂量常下调至37.5-75IU。这类人群的卵泡发育同步性差,可能出现1-2个优势卵泡伴随多个停滞卵泡的现象。子宫内膜异位症患者则相反,常需要延长刺激时间并配合生长激素辅助。
高龄或卵巢储备低下人群存在假性反应现象,即超声显示卵泡发育但实际为空泡。这类情况需要通过雌二醇与卵泡数量的比值进行识别,当单个卵泡对应雌激素低于100pg/ml时需考虑终止周期。反复治疗失败者建议转为拮抗剂方案,减少内源性LH干扰。
风险控制的临界把握
注射天数与并发症呈正相关,超过14天持续用药会显著增加卵巢扭转风险。治疗期间出现腹胀频率超过每日3次,或腹围日增超过2厘米,应立即暂停用药。血液浓缩指标如血红蛋白>150g/L、血细胞比容>45%是OHSS的预警信号。
多胎妊娠风险随成熟卵泡数量上升而递增,当双侧卵巢成熟卵泡超过3枚时,医生可能建议放弃本周期。冷冻胚胎移植策略的普及,使得现代促排卵治疗不必执着于单周期取卵数量,这种转变降低了长期注射的临床需求。
总之,尿促性素的具体注射次数本质上是动态治疗方案的外在表现,其背后是卵泡发育生物学与临床风险的精细平衡。从启动注射到触发排卵的完整周期,既是药物作用累积的过程,也是生理系统逐步响应的旅程。治疗成功的核心不在于固定天数,而在于医患双方对个体化方案的共同坚守与灵活调整。
讨论群
与本文相关问答
大家一起在讨论
相关百科
最新百科
热门百科
- 揭秘试管婴儿:从实验室到生命的奇迹之旅
- 试管婴儿被证实最多活到45岁?试管婴儿寿命研究
- 宁波妇幼做试管好吗?宁波妇幼试管技术评估
- 邵逸夫医院试管移植最好的医生?邵逸夫医院移植科医生团队
- 胚胎发育不良的幕后黑手:揭秘五大常见原因
- 胚胎移植成功率大揭秘:近年数据与实用建议
- 试管婴儿前必做的检查清单:2025年最新数据与经验分享
- 试管移植后必知的10个注意事项:轻松度过关键期