试管促黄体生成素低是什么原因?试管过程的监测和调理
在辅助生殖技术中,促黄体生成素(LH)的异常波动直接影响卵泡发育与胚胎着床。LH作为垂体前叶分泌的糖蛋白激素,其水平降低往往反映下丘脑-垂体-性腺轴的功能紊乱。临床数据显示,约15%-20%的试管婴儿周期会出现LH水平异常,其中偏低现象与多重病理因素相关。
内分泌系统的原发性功能障碍
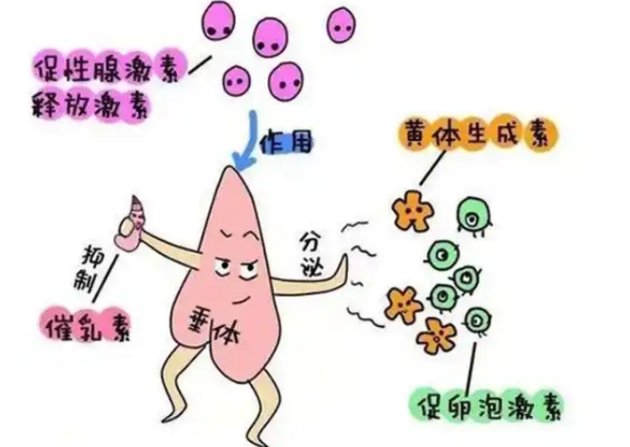
下丘脑作为神经内分泌调控中枢,其分泌的促性腺激素释放激素(GnRH)脉冲频率异常会直接抑制LH合成。垂体部位的器质性病变如微腺瘤、空蝶鞍综合征或放疗损伤,可导致促性腺激素分泌细胞功能受损。这类情况常伴随其他垂体激素如促甲状腺激素、生长激素的同步异常,需通过头颅MRI结合激素动态试验确诊。
卵巢功能的提前衰退是另一重要诱因。当卵巢储备下降至临界值时,负反馈机制异常增强,反而抑制垂体LH分泌。多囊卵巢综合征患者中约23%呈现 paradoxical LH降低,这与长期高雄激素血症导致的GnRH脉冲模式改变有关。
医源性因素与代谢干扰
控制性超促排卵方案中,外源性促卵泡激素(FSH)的过度使用可能通过短反馈抑制LH分泌。促性腺激素释放激素激动剂(GnRH-a)的降调节作用,会使垂体处于脱敏状态,导致内源性LH分泌不足。数据显示,使用长效GnRH-a方案的周期中,LH水平可降至基础值的10%-15%。
代谢异常如胰岛素抵抗会干扰下丘脑能量感知机制。肥胖患者的瘦素抵抗状态可改变kisspeptin神经元活性,间接影响GnRH分泌节律。极端体重变化(BMI<18或>30)患者的LH脉冲幅度显著低于正常人群。
生殖轴系的继发性损伤
慢性炎症性疾病如子宫内膜异位症,其病灶产生的炎性因子可通过血脑屏障影响下丘脑功能。自身免疫性垂体炎患者中,约38%出现孤立性LH缺乏。甲状腺功能异常也会干扰促性腺激素的糖基化过程,使LH生物活性降低。
药物影响不容忽视。长期使用口服避孕药可使LH基础值下降40%-60%,停药后需3-6个月恢复。精神类药物如选择性5-羟色胺再摄取抑制剂(SSRIs)通过改变多巴胺能张力抑制GnRH分泌。化疗药物对垂体促性腺激素细胞的毒性具有剂量依赖性。
检测评估与临床干预策略
血清LH检测需结合月经周期时相判断,卵泡期<3 IU/L、黄体中期<5 IU/L提示功能不足。动态监测发现LH脉冲频率<8次/24小时或振幅<7 IU/L具有诊断价值。在试管婴儿周期中,当主导卵泡直径达14mm时LH<1.5 IU/L需警惕过早黄素化风险。
补充治疗应根据病因个体化实施。下丘脑性缺陷可脉冲式给予GnRH,垂体性缺陷需直接补充重组LH制剂。对于卵巢反应不良者,添加低剂量hCG(20-50IU)可模拟LH生理作用。黄体期支持中,孕酮补充需达到血药浓度>10ng/ml才能有效维持内膜容受性。
生育力维护的综合管理
营养干预需保证每日蛋白质摄入≥1.2g/kg,锌元素>15mg以支持激素合成。运动处方建议每周150分钟中等强度有氧运动,过度训练反而抑制GnRH脉冲。压力管理通过降低皮质醇水平有助于恢复LH分泌节律,认知行为疗法可使LH脉冲频率提升20%-30%。
对于顽固性LH降低,可考虑雄激素预处理。脱氢表雄酮(DHEA)50-75mg/日使用3个月,能使AMH水平提升35%-40%,间接改善卵巢对LH的反应性。生长激素辅助治疗通过增加卵泡FSH/LH受体表达,可提高获卵数15%-20%。
在辅助生殖技术不断进步的今天,对促黄体生成素异常的精准调控成为提高成功率的关键环节。通过多学科协作的个体化方案,即使是复杂内分泌紊乱的患者,也能获得理想的妊娠结局。
讨论群
与本文相关问答
大家一起在讨论
相关百科
最新百科
热门百科
- 41岁做试管也能成功?揭秘背后的关键原因
- 43岁7个卵子可以试管吗?高龄女性卵巢储备的生理特点
- 试管促黄体生成素低是什么原因?试管过程的监测和调理
- 这五类人不宜吃紫米?备孕期间的饮食计划
- coq10对试管胚胎的作用?coq10对胚胎发育的潜在影响
- 2个月胎心停了还能恢复吗?再次妊娠的预防性措施
- 2代试管需要多久移植囊胚?取卵与胚胎培养的时间节点
- 第一次做试管身体排斥?常见症状与识别方法